
资讯 
了解行业以及华进新闻资讯。
从瑞德西韦“抢注”谈医药用途专利的申请、保护和布局策略(上)
2020-02-21
作者:信建 华进国内专利事业部

信建
华进国内专利事业部
北京生物与化学部主管
硕士毕业于山东大学神经生物学系,曾发表SCI论文三篇,其中一篇第一作者IF=7.869。自2015年起从事专利代理工作,擅长生物医药相关技术领域专利国内专利的分析、布局、撰写、复审、无效等事务。
导语
文章中提到:
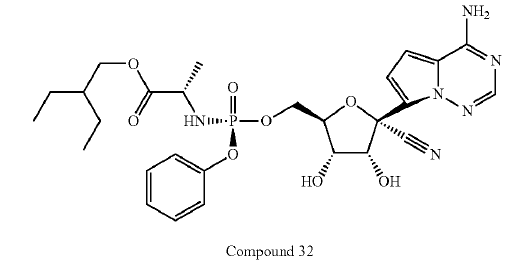
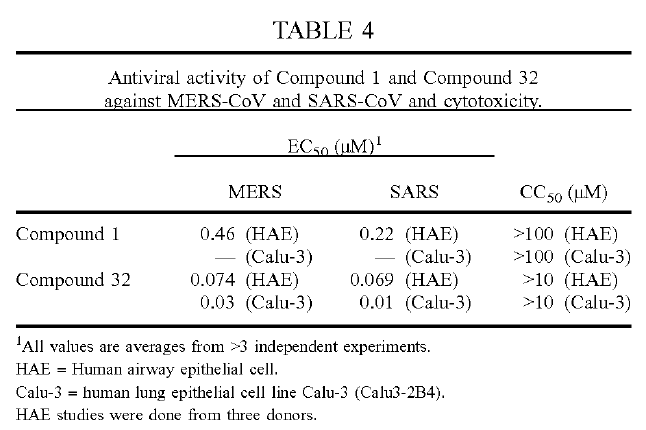
瑞德西韦(Remdesivir,GS-5734)是核苷类似物,目前在刚果(金)开展治疗埃博拉出血热的Ⅱ和Ⅲ期临床研究。磷酸氯喹(Chloroquine)于上个世纪40年代起用于治疗疟疾,后用于治疗类风湿性关节炎等。上述两种药物在细胞水平上有效抑制2019新型冠状病毒感染的初步结果此前已通过多种形式向国家和省市相关部门报告。为服务于疫情防控,合作双方单位联合声明:在上述具有抗2019新型冠状病毒(2019-nCoV)作用的药物中,我们对于国内已经上市并能够完全实现自主供应的药物磷酸氯喹,不申请相关专利,以鼓励相关企业参与疫情防控的积极性;对在我国尚未上市,且具有知识产权壁垒的药物瑞德西韦,我们依据国际惯例,从保护国家利益的角度出发,在1月21日申报了中国发明专利(抗2019新型冠状病毒的用途),并将通过PCT途径进入全球主要国家。如果国外相关企业有意向为我国疫情防控做出贡献,我们双方一致同意在国家需要的情况下,暂不要求实施专利所主张的权利,希望和国外制药公司共同协作为疫情防控尽绵薄之力。

我国专利法第二十六条第四款规定:
权利要求书应当以说明书为依据,清楚、简要地限定要求专利保护的范围。
专利法第二十六条第四款中有关权利要求应当得到说明书支持的规定的立法本意在于平衡专利权人与公众利益,专利权人所得到的权益应当与其实际所做的贡献相匹配。
《专利审查指南》第二部分第二章:
第3.2.1节明确规定,权利要求书应当以说明书为依据,是指权利要求书应当得到说明书的支持。
例:
在“胃肠基质肿瘤的治疗”发明专利权无效宣告请求案 [3] 中,合议组认为对于以“某物质在制备用于治疗某疾病的药物中的应用”形式撰写的医药用途权利要求,“治疗某疾病”应理解为对患有某疾病的患者进行治疗,其中“患者”既包括病人,也包括动物患者。尽管如此,在说明书中提供临床试验数据并不是为此类医药用途权利要求提供支持的唯一方式,在说明书中提供体外细胞实验或动物模型实验也是可选方式,但采用这些方式时应达到使本领域技术人员根据说明书提供的内容能够预期该物质具有所述用途和/或效果的程度。换言之,若权利要求请求保护药物对人体患者进行治疗,其支持程度并不意味着在临床试验时能够达到绝对的成功,而只需使得本领域技术人员对以该药物治疗人体患者的成功性有合理的预期即可。
综上
Copyright © 2021 华进联合专利商标代理有限公司.All Rights Reserved.粤ICP备12081038号